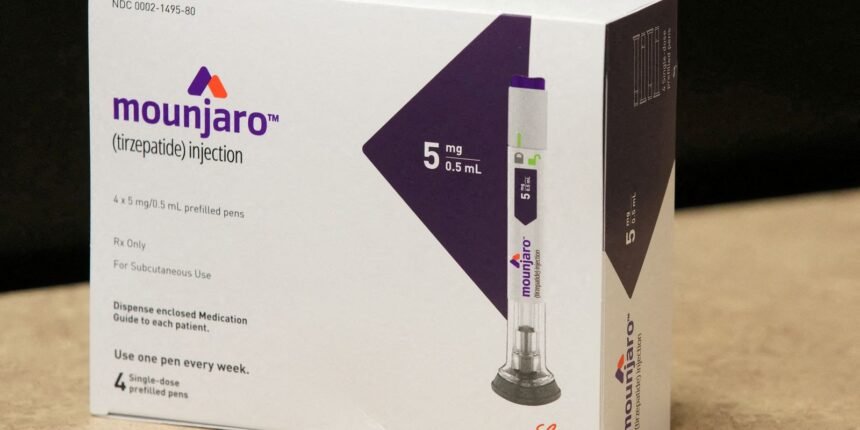
A Câmara dos Deputados deu um passo significativo nesta segunda-feira (9) ao aprovar um requerimento de regime de urgência para o Projeto de Lei nº 68/2026. A medida acelera a tramitação de um texto que visa declarar os medicamentos Mounjaro e Zepbound como de interesse público, abrindo caminho para a potencial quebra de suas patentes. Conhecidos popularmente como 'canetas emagrecedoras', esses fármacos, que são agonistas do receptor GLP-1, estão no centro de um debate que contrapõe acessibilidade e alertas crescentes sobre seus riscos à saúde.
Tramitação Acelerada na Câmara dos Deputados
A votação do requerimento de urgência obteve ampla maioria, com 337 votos favoráveis e apenas 19 contrários, demonstrando um consenso considerável entre os parlamentares sobre a necessidade de agilizar a análise da proposta. De autoria dos deputados federais Antonio Brito (PSD-BA) e Mário Heringer (PDT-MG), o Projeto de Lei nº 68/2026 agora poderá ser levado diretamente ao plenário a qualquer momento, dispensando a passagem por comissões temáticas da Casa. Este rito sumário destaca a prioridade que o legislativo atribui à discussão sobre a disponibilidade e o custo desses medicamentos.
Mounjaro e Zepbound: O Potencial de Interesse Público e a Quebra de Patente
Os medicamentos Mounjaro (tirzepatida) e Zepbound, ambos produzidos pela farmacêutica Eli Lilly, são prescritos para o tratamento de diabetes tipo 2 e, mais recentemente, para o controle de peso em pessoas com obesidade ou sobrepeso com comorbidades. A declaração de interesse público, conforme o PL, pode ser um precursor para a concessão de licenças compulsórias ou 'quebra de patente', permitindo que outras empresas produzam versões genéricas ou biossimilares dos fármacos a preços mais acessíveis. Tal movimento visa ampliar o acesso a tratamentos caros, mas de alta demanda, que têm mostrado eficácia no manejo de condições de saúde pública relevantes.
Alertas Sanitários da Anvisa e o Risco de Pancreatite
Paralelamente à discussão legislativa, agências reguladoras têm intensificado os alertas sobre os riscos associados ao uso indevido das 'canetas emagrecedoras'. A Agência Nacional de Vigilância Sanitária (Anvisa) emitiu um alerta de farmacovigilância abrangendo medicamentos como dulaglutida, liraglutida, semaglutida e a própria tirzepatida. Embora os riscos, incluindo a pancreatite aguda, já constem nas bulas dos produtos aprovados no Brasil, a Anvisa observou um aumento nas notificações de eventos adversos, tanto no cenário nacional quanto internacional. Essa elevação exige um reforço nas orientações de segurança para profissionais de saúde e pacientes.
Preocupações Internacionais e a Necessidade de Monitoramento Médico Rigoroso
O monitoramento médico é crucial, segundo a Anvisa, devido à possibilidade de eventos adversos graves, com destaque para a pancreatite aguda, que pode evoluir para formas necrotizantes e até fatais. Essa preocupação não é isolada. No início do mesmo mês, a Agência Reguladora de Medicamentos e Produtos de Saúde (MHRA) do Reino Unido também emitiu um alerta similar. A agência britânica destacou o risco, ainda que considerado pequeno, de casos de pancreatite aguda grave em pacientes que utilizam esses medicamentos, sublinhando a importância da vigilância constante e da prescrição e uso sob estrita supervisão profissional. Os alertas internacionais corroboram a urgência de conscientização e cautela no uso desses tratamentos.
A aprovação da urgência para o Projeto de Lei que discute a quebra de patente de Mounjaro e Zepbound coloca em evidência a complexa intersecção entre inovação farmacêutica, saúde pública e políticas de acesso. Enquanto o país avança em uma discussão legislativa para tornar esses tratamentos mais acessíveis, os órgãos de vigilância sanitária reiteram a importância vital da conscientização sobre seus riscos e do acompanhamento médico rigoroso. O desfecho da votação no plenário será crucial para definir os próximos passos em relação à disponibilidade e ao controle desses medicamentos no Brasil.